Tafinlar®, comprimé pour suspension buvable
Information destinée aux patients en Suisse
Qu’est-ce que TAFINLAR et quand doit-il être utilisé ?
Tafinlar contient la substance active dabrafénib et inhibe la croissance des cellules cancéreuses.
– Tafinlar, seul ou en association avec Mekinist (tramétinib), est utilisé dans le traitement du cancer noir de la peau (mélanome) inopérable ou ayant formé des métastases.
– Tafinlar en association avec Mekinist (tramétinib) est également utilisé chez les patients dont le mélanome a pu être excisé chirurgicalement, afin de prévenir la réapparition du mélanome.
– Tafinlar en association avec Mekinist (tramétinib), est utilisé dans le traitement d’une forme de cancer du poumon (cancer du poumon non à petites cellules (CPNPC)).
– Tafinlar en association avec Mekinist (tramétinib) est utilisé dans le traitement de patients adultes présentant une tumeur solide non résécable ou métastatique porteuse d’une mutation BRAF V600E, qui a progressé après un traitement antérieur et pour laquelle il n’existe pas d’autres possibilités de traitement satisfaisantes.
– Les gliomes, un type de tumeur cérébrale, chez les enfants de plus d’un an qui nécessitent un traitement supplémentaire après des options de traitement alternatives.
Dans cette notice, il est également fait référence à la substance active tramétinib (nom commercial Mekinist), car celle-ci peut être administrée en association avec Tafinlar (dabrafénib). Veuillez lire attentivement la notice d’emballage de Mekinist (tramétinib) en plus de la présente notice d’emballage.
Tafinlar en monothérapie ou en association avec Mekinist (tramétinib) ne peut être utilisé que chez les personnes dont le cancer présente une certaine modification (mutation) sur le gène dit BRAF. Tafinlar et Mekinist (tramétinib) agissent sur les protéines que l’organisme synthétise en raison de ce gène modifié, ralentissant ou stoppant ainsi le développement de votre cancer. Votre médecin prélèvera un échantillon de tissu tumoral afin de déterminer si le traitement par Tafinlar ou Tafinlar en association avec Mekinist (tramétinib) est possible dans votre cas.
Selon prescription du médecin.
Quand TAFINLAR ne doit-il pas être pris/utilisé ?
Tafinlar ne doit pas être utilisé en cas d’hypersensibilité au principe actif, le dabrafénib, ou à l’un des excipients.
Quelles sont les précautions à observer lors de la prise/de l’utilisation deTAFINLAR ?
Si votre cancer est traité par une association de Tafinlar et de Mekinist (tramétinib), veuillez également lire attentivement la notice d’emballage de Mekinist (tramétinib). L’association de Tafinlar et du tramétinib ne doit pas être utilisée chez des patients présentant des tumeurs à gène BRAF de type sauvage ou un cancer colorectal.
Avant et pendant que vous prenez Tafinlar, votre médecin doit savoir:
– si vous avez ou avez eu des problèmes de reins ou de foie. Discutez des problèmes hépatiques existants avec votre médecin. Il ou elle contrôlera alors régulièrement vos paramètres hépatiques avant et pendant le traitement;
– si vous souffrez de diabète. Dans ce cas, votre médecin surveillera plus étroitement vos taux de glycémie;
– si vous ressentez des douleurs intenses et inexpliquées dans la partie supérieure de l’abdomen. Votre médecin vous examinera pour savoir si vous avez une inflammation du pancréas (pancréatite). S’il est confirmé que vous avez une inflammation du pancréas (pancréatite), votre médecin effectuera des analyses de sang régulières;
– si vous avez un problème oculaire appelé uvéite (il s’agit d’une inflammation de la membrane interne de l’œil qui, en l’absence de traitement, peut altérer la vue). L’uvéite peut se développer rapidement. Les symptômes sont:
– rougeur et irritation des yeux
– vision floue
– douleurs oculaires
– sensibilité accrue à la lumière
– corps flottants devant l’œil
Il est important que vous contactiez immédiatement votre médecin si vous présentez ces symptômes, en particulier si vous avez un œil rouge et douloureux qui ne se rétablit pas rapidement. Il peut être nécessaire de faire appel à un spécialiste de la vue;
– si vous avez une température corporelle élevée de manière durable, qui peut être accompagnée de frissons intenses, d’une déshydratation et d’une hypotension. Si vous développez une fièvre avec une température supérieure ou égale à 38 °C, contactez immédiatement votre médecin. Il ou elle effectuera des tests pour déterminer s’il y a d’autres causes à la fièvre et traitera le problème;
– pendant et après des épisodes de fièvre sévères, certaines substances (enzymes) peuvent présenter des taux anormalement élevés; votre médecin mesurera les taux d’enzymes et vérifiera que vos reins fonctionnent correctement;
– si des hémorragies surviennent, en particulier si les signes suivants d’une hémorragie intracrânienne surviennent: sensation de vertiges, nausées, vomissements, vertiges, maux de tête extrêmement intenses et raideur de la nuque;
– si des douleurs thoraciques, un essoufflement soudain, des difficultés respiratoires, des douleurs dans les jambes avec ou sans gonflement, un gonflement du bras ou de la jambe, ou un bras froid et pâle ou une jambe froide et pâle surviennent, car il peut s’agir de signes d’un caillot de sang dans les veines du bras ou de la jambe, des poumons ou d’autres parties du corps;
– si vous présentez simultanément plusieurs symptômes, tels que fièvre, gonflement des ganglions, hématomes ou éruption cutanée. Ces symptômes peuvent être le signe d’une lymphohistiocytose hémophagocytaire (LHH), une maladie dans laquelle le système immunitaire produit trop de cellules de défense contre les infections (appelées histiocytes et lymphocytes);
– si vous présentez simultanément plusieurs symptômes, tels qu’un rythme cardiaque irrégulier, une diminution de l’excrétion de l’urine, une confusion, de fortes nausées et des vomissements, un essoufflement, des crampes ou contractions musculaires, qui peuvent être les signes d’un syndrome de lyse tumorale ou SLT, un trouble dû à la dégradation rapide des cellules cancéreuses;
– si vous souffrez d’un déficit en glucose-6-phosphate déshydrogénase (G6PD). Dans ce cas, votre médecin vous surveillera plus étroitement afin de détecter une éventuelle anémie;
– si vous avez des problèmes de peau, par exemple une éruption cutanée ou des manifestations semblables à une acné;
– si vous remarquez des modifications de votre peau, par exemple:
– nouvelles verrues,
– peau rêche/lésée ou surélévations rougeâtres qui saignent ou ne guérissent pas,
– changement de taille ou de couleur d’un grain de beauté.
Si vous constatez des modifications de la peau pendant le traitement par Tafinlar, vous devez en informer votre médecin le plus rapidement possible. Jusqu’à une personne sur 10 prenant Tafinlar peut développer un autre type de cancer de la peau. Normalement, ces lésions restent localisées, elles peuvent être enlevées chirurgicalement et le traitement par Tafinlar peut être poursuivi.
Certaines personnes prenant Tafinlar peuvent éventuellement observer l’apparition de nouveaux mélanomes. Normalement, ces lésions peuvent être enlevées chirurgicalement et le traitement peut être poursuivi.
Votre médecin examinera votre peau avant le traitement par Tafinlar, tous les 2 mois pendant le traitement, et tous les 2 à 3 mois pendant 6 mois après l’arrêt du traitement.
Votre médecin peut vous examiner avant, pendant et après le traitement par Tafinlar afin d’exclure le développement d’un autre cancer chez vous.
Consultez votre médecin si vous pensez que vous souffrez de l’une des maladies mentionnées ci-dessus ou que l’une de ces maladies survient pendant le traitement par Tafinlar.
Des réactions cutanées graves ont été observées chez des patients prenant Tafinlar en même temps que Mekinist:
– éruption, peau rouge, formation de cloques sur les lèvres, les yeux ou dans la bouche, desquamation avec ou sans fièvre; il peut s’agir de signes possibles d’un syndrome de Stevens-Johnson;
– éruption cutanée étendue, fièvre et ganglions lymphatiques hypertrophiés (il peut s’agir de signes d’un exanthème médicamenteux avec éosinophilie et symptômes systémiques (DRESS)).
Si vous remarquez des modifications de la peau pendant la prise de Tafinlar, vous devez en informer votre médecin le plus rapidement possible (voir «Quels effets secondaires Tafinlar peut-il provoquer ?»).
Les hommes peuvent avoir un nombre réduit de spermatozoïdes pendant un traitement par Tafinlar. Il se peut que celui-ci ne revienne pas à des valeurs normales après l’arrêt du médicament. Pour toute autre question à ce sujet, veuillez contacter votre médecin ou votre pharmacien.
L’utilisation simultanée de Tafinlar et d’autres médicaments peut entraîner une amplification ou une atténuation des effets (souhaités et indésirables) de Tafinlar ou une amplification des effets des autres médicaments. Parmi ces médicaments, on trouve par exemple:
Certains antibiotiques, fongicides, médicaments contre le VIH (SIDA) ou médicaments de type cortisone, médicaments contre l’épilepsie, antidépresseurs, certains anticoagulants, contraception hormonale (pilule, injections, patchs), médicaments destinés à réduire les taux de lipides sanguins ainsi que les médicaments destinés à réduire l’acidité gastrique. Informez votre médecin si vous utilisez d’autres médicaments. Il ou elle décidera quels sont ceux que vous pouvez utiliser en même temps que Tafinlar et à quelle dose vous devez prendre Tafinlar.
Tafinlar, seul ou en association avec Mekinist (tramétinib), peut entraîner une aggravation de certaines maladies préexistantes ou provoquer des effets secondaires graves. Vous devez donc savoir quels sont les signes et symptômes importants auxquels vous devez faire attention pendant le traitement (voir aussi: «Quels effets secondaires Tafinlar peut-il provoquer ?»; Prise de Tafinlar et prise de Tafinlar en association avec Mekinist (tramétinib)).
Tafinlar et Mekinist (tramétinib) ne sont pas recommandés chez les patients pédiatriques âgés de moins d’un an.
Chaque comprimé dispersible contient < 0,00078 mg d’alcool benzylique. L’alcool benzylique peut provoquer des réactions allergiques.
Ne pas utiliser ce médicament pendant plus d’une semaine chez le jeune enfant (de moins de 3 ans), sauf sur l’avis de votre médecin ou de votre pharmacien.
Si vous êtes enceinte ou si vous allaitez, demandez conseil à votre médecin ou à votre pharmacien, car des quantités importantes d’alcool benzylique peuvent s’accumuler dans votre corps et provoquer des effets secondaires (appelés «acidose métabolique»).
Si vous souffrez d’une affection du foie ou des reins, demandez conseil à votre médecin ou à votre pharmacien, car des quantités importantes d’alcool benzylique peuvent s’accumuler dans votre corps et provoquer des effets secondaires (appelés «acidose métabolique»).
Si vous avez pris récemment d’autres médicaments ou si vous avez l’intention de prendre d’autres médicaments, veuillez en informer votre médecin. Ceci s’applique également aux médicaments qui ne sont pas soumis à une prescription médicale.
Dressez une liste des médicaments que vous utilisez et montrez-la à votre médecin lorsque vous recevez un nouveau médicament.
Veuillez informer votre médecin ou votre pharmacien si
– vous souffrez d’une autre maladie
– vous êtes allergique
– vous prenez déjà d’autres médicaments ou utilisez déjà d’autres médicaments en usage externe (même en automédication !).
TAFINLAR peut-il être pris/utilisé pendant la grossesse ou l’allaitement ?
L’utilisation de Tafinlar, que ce soit en monothérapie ou en association avec Mekinist (tramétinib), n’est pas recommandée pendant la grossesse. Veuillez informer votre médecin avant le début du traitement si vous êtes enceinte, si vous pensez l’être ou si vous envisagez une grossesse. Il se peut qu’il ou elle vous recommande de faire un test de grossesse avant de commencer le traitement par Tafinlar.
Tafinlar n’est pas recommandé pendant l’allaitement. On ignore si les composants de Tafinlar passent dans le lait maternel. Discutez avec votre médecin de la marche à suivre si vous allaitez ou souhaitez allaiter.
Femmes en âge de procréer et patients de sexe masculin
Les femmes en âge de procréer doivent utiliser des méthodes contraceptives efficaces pendant un traitement par Tafinlar et pendant les deux semaines qui suivent la fin de celui-ci. Comme l’efficacité des méthodes de contraception hormonales (comme la pilule, les injections ou les patchs) peut être compromise, il convient d’utiliser des méthodes supplémentaires (par exemple des préservatifs). Si vous prenez Tafinlar en association avec Mekinist, vous devez utiliser une méthode de contraception fiable pendant au moins 16 semaines après la fin du traitement combiné. Si une grossesse survient pendant le traitement par Tafinlar, le médecin doit en être informé immédiatement.
Les hommes qui prennent Tafinlar peuvent voir leur nombre de spermatozoïdes diminuer pendant la prise, et il est possible que le nombre de spermatozoïdes ne revienne pas à un niveau normal après l’arrêt de la prise de Tafinlar.
Si vous avez d’autres questions concernant l’effet de ce médicament sur le nombre de spermatozoïdes, consultez votre médecin.
Comment utiliser TAFINLAR ?
Tafinlar vous est généralement prescrit par un(e) spécialiste des tumeurs et ses instructions doivent être strictement suivies.
Chez les enfants de plus d’un an, la dose recommandée de Tafinlar, prise deux fois par jour, est déterminée par votre médecin en fonction du poids corporel.
Il est important de ne pas prendre Tafinlar en même temps qu’un repas. Tafinlar doit être pris chaque jour à la même heure, soit au moins une heure avant, soit au moins deux heures après un repas.
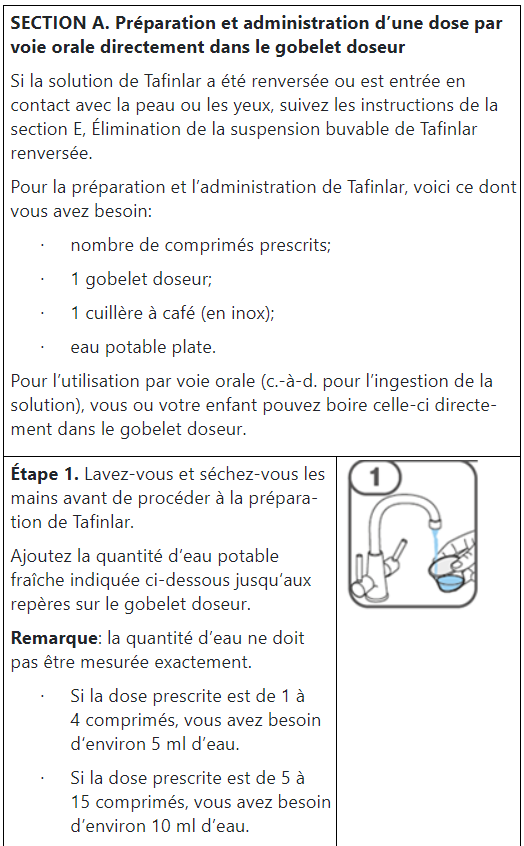
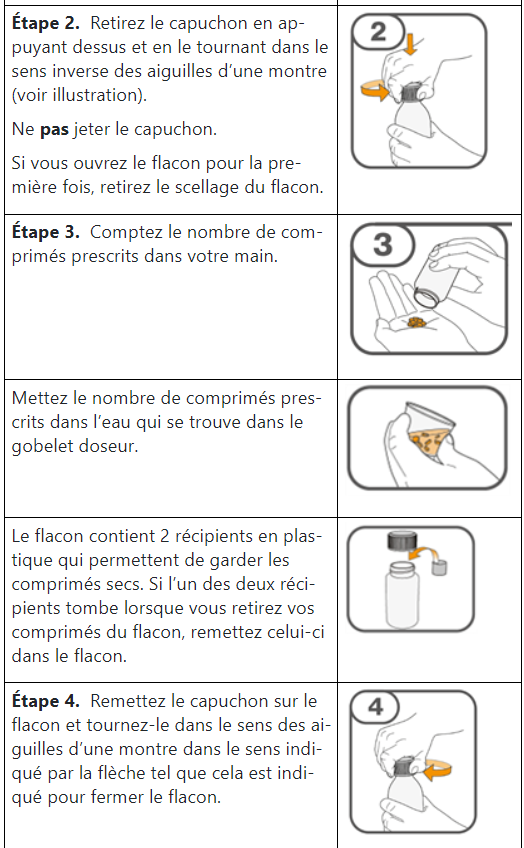
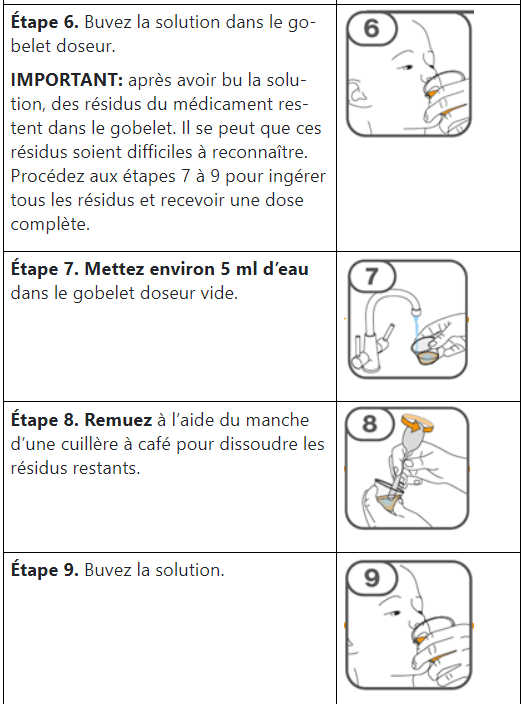
Prise de Tafinlar comprimés dispersibles
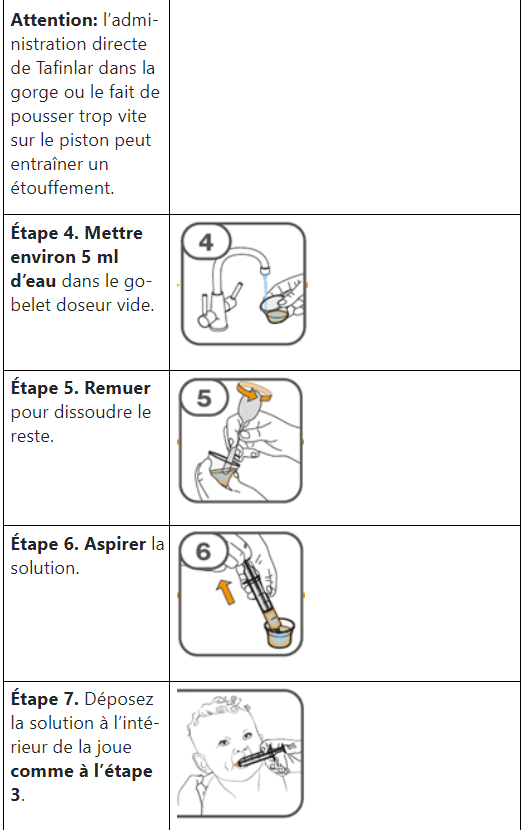
Les comprimés de Tafinlar ne doivent être pris que sous forme de suspension orale (après dissolution dans de l’eau) et ne doivent pas être avalés entiers, mâchés ou écrasés. Veuillez suivre les instructions figurant à la fin de cette notice pour la préparation et la prise de la suspension. Demandez conseil à votre médecin ou à votre pharmacien en cas de doute.
Si vous présentez des effets secondaires, votre médecin peut vous prescrire une dose plus faible, interrompre le traitement ou arrêter complètement le traitement.
Si vous avez oublié une dose de Tafinlar et qu’il reste plus de 6 heures avant la prochaine prise prévue, prenez la dose oubliée. S’il reste moins de 6 heures avant la prochaine prise prévue, ne prenez pas la dose oubliée et prenez la dose suivante à l’heure habituelle.
Ne prenez jamais une double dose simultanément.
Si vous avez pris trop de gélules ou de comprimés de Tafinlar, contactez votre médecin. Si possible, montrez-lui l’emballage de Tafinlar.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
N’arrêtez pas de prendre ce médicament, sauf si votre médecin vous le conseille.
Tafinlar n’est pas recommandé chez les patients pédiatriques âgés de moins d’un an.
Quels effets secondaires TAFINLAR peut-il provoquer ?
Prise de Tafinlar
Soyez attentif aux symptômes suivants:
Fièvre: Tafinlar peut provoquer de la fièvre. Informez immédiatement votre médecin ou votre pharmacien en cas de température corporelle élevée de manière durable pendant le traitement par Tafinlar. Il ou elle déterminera, à l’aide de tests, si la fièvre a d’autres causes et traitera le problème. Dans certains cas, les personnes ayant de la fièvre peuvent développer une hypotension et des vertiges. En cas de forte fièvre, votre médecin peut éventuellement arrêter temporairement le traitement par Tafinlar.
Si les symptômes suivants apparaissent, il faut en informer immédiatement le médecin: fortes douleurs dans la partie supérieure de l’abdomen, nausées ou vomissements, respiration rapide et profonde, malaise, perte d’appétit et/ou de poids. Il peut s’agir des premiers signes d’un effet indésirable qui, s’il évolue, peut mettre la vie en danger, comme une pancréatite.
Très fréquent (concerne plus d’un utilisateur sur 10)
Épaississement de la peau, problèmes cutanés (éruption cutanée, excroissances semblables à des verrues, qui peuvent également dégénérer de manière maligne, rougeurs, gonflements de la paume des mains, des doigts et de la plante des pieds), maux de tête, diarrhée, nausées, vomissements, perte d’appétit, constipation, frissons, fièvre, toux, sensation de faiblesse, manque d’énergie, douleurs articulaires, douleurs musculaires ou douleurs aux mains et aux pieds, perte de cheveux inhabituelle ou raréfaction des cheveux.
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Douleurs thoraciques, essoufflement soudain, difficultés respiratoires, douleurs dans les jambes avec ou sans gonflement, gonflement du bras ou de la jambe, ou un bras froid et pâle ou une jambe froide et pâle; il peut s’agir de signes d’un caillot de sang dans les veines du bras ou de la jambe, des poumons ou d’autres parties du corps.
Symptômes pseudo-grippaux, inflammation du rhinopharynx, diminution du phosphore sanguin, augmentation de la glycémie, problèmes cutanés (sécheresse, rougeur, épaississement brun ou jaunâtre de la peau, excroissances de la peau, taches cutanées rugueuses qui pèlent, démangeaisons), sensibilité à la lumière, insuffisance rénale, diminution de la performance cardiaque, arythmie cardiaque, problèmes nerveux pouvant provoquer des douleurs, une perte de sensations ou un fourmillement dans les mains et les pieds/une faiblesse musculaire (neuropathie périphérique).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Inflammation de l’œil (uvéite), inflammation du pancréas (qui peut s’accompagner de fortes douleurs abdominales; votre médecin surveillera étroitement votre pancréas en cas d’apparition d’une inflammation), inflammation du tissu adipeux sous la peau (qui peut s’accompagner de zones cutanées nodulaires et douloureuses), réaction allergique, nouveau mélanome.
Rare (concerne 1 à 10 utilisateurs sur 10 000)
Inflammation des reins.
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
Rougeur de la peau dans la zone d’une irradiation précédente (phénomène de rappel).
Prise de Tafinlar en association avec Mekinist (tramétinib)
Lisez également attentivement la notice de Mekinist (tramétinib) pour connaître les effets secondaires tels que les maladies cardiaques et les problèmes oculaires (troubles visuels).
Hémorragies: la prise de Tafinlar en association avec Mekinist peut provoquer des hémorragies graves, notamment dans le cerveau ou l’estomac. Appelez votre médecin ou votre infirmier/ère et demandez immédiatement une aide médicale si vous présentez des signes inhabituels d’hémorragies, par exemple:
– maux de tête, vertiges ou faiblesse;
– crachats de sang ou de caillots sanguins;
– vomissements contenant du sang ou ressemblant à du marc de café;
– saignements de nez;
– selles rouges ou noires, ressemblant à du goudron.
Modifications de la peau
Si vous constatez des modifications de la peau, vous devez en informer votre médecin le plus rapidement possible. Des réactions cutanées graves ont été rapportées chez des patients traités par Tafinlar associé à Mekinist. Veuillez prêter attention aux signes suivants:
– rougeurs rondes avec une vésicule au centre, desquamation de la peau;
– ulcères (appelés ulcérations) dans la bouche, la gorge, le nez, la région des yeux et les parties intimes. Ces éruptions cutanées graves peuvent être précédées de fièvre et de symptômes pseudo-grippaux (syndrome de Stevens-Johnson);
– éruptions cutanées étendues, fièvre et ganglions lymphatiques hypertrophiés (syndrome d’hypersensibilité médicamenteuse (DRESS)).
Si les modifications ou les symptômes mentionnés ci-dessus apparaissent, le traitement par Tafinlar et Mekinist doit être immédiatement arrêté.
Effets secondaires possible chez les enfants lorsque Tafinlar est pris en même temps que Mekinist
Très fréquent (concerne plus d’un utilisateur sur 10)
Réduction du nombre d’un type de globule blanc (neutropénie), inflammations cutanées de type acnéique, inflammation du lit de l’ongle (paronychie), anémie, réduction du nombre total de globules blancs (leucopénie), prise de poids, augmentation des taux de transaminases.
Inflammation du nez et de la gorge, diminution de l’appétit, maux de tête, sensation vertigineuse, pression artérielle élevée (hypertension), saignements (hémorragies, généralement légères, mais pouvant aller jusqu’à des hémorragies fatales), toux, nausées, diarrhée, vomissements, maux de ventre (douleurs abdominales), constipation, augmentation des transaminases, éruption cutanée, peau sèche, démangeaisons, rougeur de la peau (érythème), douleurs articulaires (arthralgie), douleurs musculaires (myalgie), douleurs dans les mains et les pieds, crampes musculaires, fièvre, fatigue, frissons, gonflement des mains et des pieds (syndrome mains-pieds), manque d’énergie, sensation de faiblesse (asthénie), maladie pseudo-grippale.
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Rougeur et desquamation de la peau sur de larges zones du corps (dermatite exfoliative généralisée), hypersensibilité, inflammation du pancréas (pancréatite), infection des voies urinaires, infection de la peau (cellulite), inflammation de la cavité nasopharyngienne (rhinopharyngite), inflammation des follicules pileux dans la peau (folliculite), douleurs des ongles, infection et gonflement des cuticules, effets sur la peau, par exemple des zones de peau rêche et squameuse, éruption cutanée avec des vésicules purulentes, carcinome épidermoïde cutané (un type de cancer de la peau), papillome (un type de tumeur cutanée généralement bénigne), épaississement brun ou jaunâtre de la peau (kératose et hyperkératose), diminution du nombre de plaquettes (cellules qui aident le sang à coaguler (thrombopénie)), manque d’eau dans l’organisme (déshydratation), faible taux de sodium dans le sang (hyponatrémie), faible taux de phosphate dans le sang (hypophosphatémie), soif excessive, grande quantité d’urine, urines foncées, augmentation de l’appétit avec perte de poids, peau sèche et rouge, irritabilité comme signe d’un taux élevé de sucre (glucose) dans le sang (signe d’hyperglycémie), vision floue, détérioration de la vue, inflammation de l’œil (uvéite), pompage moins efficace du cœur (réduction de la fraction d’éjection), ralentissement des battements cardiaques (bradycardie), pression artérielle basse (hypotension), accumulation de liquide dans les extrémités (lymphœdème), essoufflement (dyspnée), bouche sèche, inflammation des muqueuses buccales (stomatite), augmentation de certaines substances produites par le foie (enzymes telles que la gamma-glutamyltransférase et la phosphatase alcaline), sueurs nocturnes, perte des cheveux inhabituelle ou raréfaction des cheveux (alopécie), excroissances de type verruqueux ou rougeurs et gonflements de la paume des mains, des doigts et de la plante des pieds, lésions de la peau (lésions cutanées), craquelures cutanées, transpiration excessive, inflammation du tissu adipeux sous la peau (panniculite), sensibilité à la lumière, augmentation de la créatine phosphokinase dans le sang, une enzyme qui se trouve surtout dans le cœur, le cerveau et les muscles squelettiques, insuffisance rénale (maladie des reins qui peut entraîner une limitation de l’élimination de l’urine) et insuffisance rénale aiguë, inflammation des muqueuses (pas seulement dans la bouche), gonflement local des tissus, p.ex. gonflement du visage (œdème du visage), rythme cardiaque irrégulier (bloc de branche).
Douleurs thoraciques, essoufflement soudain, difficultés respiratoires, douleurs dans les jambes avec ou sans gonflement, gonflement d’un bras ou d’une jambe, ou un bras froid et pâle ou une jambe froide et pâle; il peut s’agir de signes d’un caillot sanguin dans les veines du bras ou de la jambe, des poumons ou d’une autre partie du corps; problèmes nerveux pouvant provoquer des douleurs, une perte de sensations ou un fourmillement dans les mains et les pieds/une faiblesse musculaire (neuropathie périphérique).
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Nouveau mélanome primitif, fibromes (verrues pédiculaires), sarcoïdose (maladie inflammatoire touchant principalement les voies respiratoires, la peau, le cœur et les yeux), réactions allergiques aux médicaments, modifications oculaires, p. ex. gonflement de l’œil causé par un écoulement de liquide (choriorétinopathie), décollement de la membrane photosensible à l’arrière de l’œil (la rétine) des couches de support (décollement de l’épithélium pigmentaire rétinien/décollement de la rétine), gonflement dans la région de l’œil, ralentissement du rythme cardiaque (bradycardie), pneumonie (pneumopathie inflammatoire) et autres maladies pulmonaires (pneumopathie interstitielle diffuse), inflammation du pancréas, diarrhée, douleurs abdominales, fièvre (signes de colite), fortes douleurs à l’estomac, nausées (signes d’une perforation gastrique ou intestinale), inflammation des reins, modification de la manière dont le cœur pompe le sang (dysfonctionnement du ventricule gauche), insuffisance cardiaque (diminution de la fonction cardiaque pouvant entraîner des problèmes respiratoires en position couchée, de la fatigue ou un gonflement des jambes), dégradation du tissu musculaire (rhabdomyolyse) pouvant entraîner des douleurs, de la fièvre et une urine rouge-brun. Rythme cardiaque irrégulier (bloc de branche).
Rare (concerne 1 à 10 utilisateurs sur 10 000)
Inflammation du tissu du muscle cardiaque, inflammation du muscle cardiaque (myocardite) pouvant entraîner des difficultés respiratoires, de la fièvre, des palpitations ou des tachycardies et des douleurs dans la poitrine, peau enflammée et qui pèle (dermatite exfoliative), perforation de l’estomac ou de l’intestin (perforation gastro-intestinale).
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
Lymphohistiocytose hémophagocytaire (une affection dans laquelle le système immunitaire produit trop de cellules de défense contre les infections), plusieurs symptômes survenant simultanément, tels qu’un rythme cardiaque irrégulier, une diminution de l’excrétion de l’urine, une confusion, de fortes nausées et des vomissements, un essoufflement, des crampes ou contractions musculaires («syndrome de lyse tumorale» ou SLT). Taches ou lésions cutanées rouges à rouge foncé-violet, douloureuses, surélevées, qui se développent surtout sur les bras, les jambes, le visage et le cou et qui sont accompagnées de fièvre (signes d’une dermatose aiguë fébrile neutrophilique ou syndrome de Sweet), rougeur de la peau dans la zone d’une irradiation précédente (phénomène de rappel).
Effets secondaires possibles chez les adultes lorsque Tafinlar est pris en même temps que Mekinist
Dans l’ensemble, les effets indésirables observés chez les enfants étaient similaires à ceux observés chez les adultes. D’autres effets secondaires apparus plus rarement chez les adultes que chez les enfants sont:
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Diminution du nombre d’un type de globule blanc (neutropénie), inflammations cutanées de type acnéique, inflammation du lit de l’ongle (paronychie), anémie, Diminution du nombre total de globules blancs (leucopénie), papillome de la peau.
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Ralentissement des battements cardiaques (bradycardie), rougeur et desquamation sur de larges zones du corps (dermatite exfoliative généralisée), hypersensibilité et inflammation du pancréas (pancréatite).
Si vous remarquez des effets secondaires qui ne sont pas décrits ici, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention ?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Comprimés dispersibles
Ne pas conserver au-dessus de 30 °C.
Conserver les comprimés dans leur emballage d’origine pour les protéger de l’humidité. Ne pas enlever le dessicant. Conserver hors de la portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d’une information détaillée destinée aux professionnels.
Que contient TAFINLAR ?
Principes actifs
1 comprimé dispersible contient 10 mg de dabrafénib (sous forme de mésylate de dabrafénib).
Excipients
Mannitol (E421), cellulose microcristalline, crospovidone, hypromellose (E464), acésulfame potassique, stéarate de magnésium, arôme artificiel de baies (contient de l’alcool benzylique), silice colloïdale anhydre.
Numéro d’autorisation
69135 (Swissmedic)
Où obtenez-vous TAFINLAR ? Quels sont les emballages à disposition sur lemarché ?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Tafinlar 10 mg comprimés dispersibles: emballages de 210 comprimés. Chaque emballage inclut 2 gobelets doseurs.
Titulaire de l’autorisation
Novartis Pharma Schweiz AG, Risch; domicile: 6343 Rotkreuz.
Cette notice d’emballage a été vérifiée pour la dernière fois en septembre 2024 par l’autorité de contrôle des médicaments (Swissmedic).
Remarques concernant l’utilisation et la manipulation










Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 04.12.2024, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans le paragraphe en gras juste ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 4ème mise à jour de cette page depuis le lancement début 2021 de cette rubrique. Mise à jour 1 (janvier 2024). Mise à jour 2 (juin 2024). Mise à jour 3 (octobre 2024). Mise à jour 4 (décembre 2024).
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


