Spinraza®
Information destinée aux patients en Suisse
Qu’est-ce que Spinraza et quand doit-il être utilisé ?
Spinraza est utilisé sur prescription médicale pour traiter une maladie génétique, appelée atrophie musculaire spinale ou amyotrophie spinale (SMA). Spinraza contient la substance active nusinersen, qui appartient à un groupe de médicaments appelés oligonucléotides antisens.
Qu’est-ce que l’atrophie musculaire spinale ?
L’atrophie musculaire spinale est causée par un déficit d’une protéine appelée SMN (survival motor neuron, protéine de survie des motoneurones) dans l’organisme. Il en résulte une perte de cellules nerveuses dans la colonne vertébrale, ce qui entraîne une faiblesse musculaire dans les épaules, les hanches, les cuisses et dans la région du haut du dos. Les muscles permettant de respirer et d’avaler peuvent parfois aussi être affaiblis.
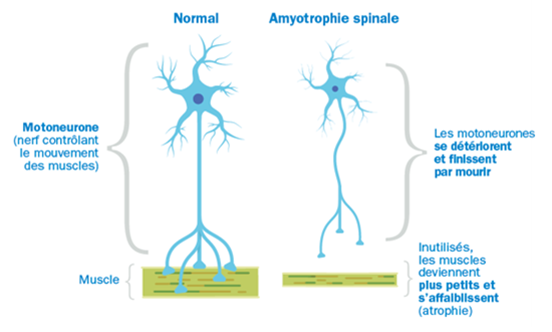
Comment Spinraza agit-il ?
Spinraza agit en aidant l’organisme à produire une quantité plus importante de la protéine SMN. Cela permet alors de réduire la perte des cellules nerveuses et d’améliorer ainsi la force musculaire.

Comment nusinersen a été évalué ?
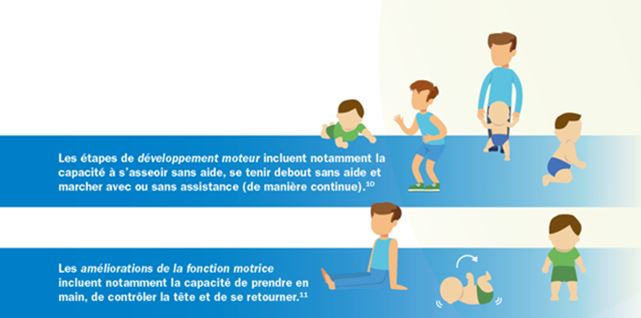
Des études cliniques menées chez des enfants ont montré que nusinersen a aidé à améliorer leurs fonctions motrices et d’atteindre les étapes du développement moteurs (par exemple contrôle de la tête, position assise sans aide, ou se tenir debout; voir la figure prochaine.)
Le traitement par Spinraza a montré d’aider des patients SMA d’âge divers et d’atteints de plusieurs formes, comme SMA de la forme infantile (type 1), SMA de la forme d’apparition plus tardive (type II/III) et SMA présymptomatique ayant un diagnostic génétique.
Si la maladie a dépassé un certain stade (p.ex. l’indispensabilité de la ventilation permanente), l’efficacité de Spinraza est diminuée par rapport à l’instauration du traitement à un stade de la maladie plus tôt.
De quoi faut-il tenir compte en dehors du traitement ?
Spinraza contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire quasiment «sans sodium» et peut être utilisé par les patients qui doivent suivre un régime pauvre en sel.
Quand Spinraza ne doit-il pas être utilisé ?
Spinraza ne doit pas être utilisé
– si vous ou votre enfant êtes allergique au nusinersen ou à l’un des excipients.
En cas de doute, adressez-vous à votre médecin avant que vous ou votre enfant ne receviez un traitement par Spinraza.
Quelles sont les précautions à observer lors de l’utilisation de Spinraza ?
Il existe un risque de survenue d’effets secondaires après l’administration de Spinraza par ponction lombaire. Ces derniers peuvent inclure des maux de tête, des vomissements et des maux de dos. L’administration d’un médicament par ponction lombaire chez les patients très jeunes et chez les patients présentant une scoliose (courbure et torsion de la colonne vertébrale) peut s’avérer difficile.
Il a été démontré que d’autres médicaments appartenant au même groupe de substances que Spinraza ont un effet sur les cellules sanguines responsables de la coagulation. Avant que vous ou votre enfant ne receviez Spinraza, votre médecin réalisera une analyse de sang afin de vérifier la capacité de coagulation. Votre médecin répétera cette analyse à intervalles réguliers durant le traitement par Spinraza.
Il a été démontré que d’autres médicaments appartenant au même groupe de substances que Spinraza ont un effet sur les reins. Avant que vous ou votre enfant ne receviez Spinraza, votre médecin réalisera une analyse d’urine afin de vérifier la fonction rénale. Votre médecin répétera cette analyse à intervalles réguliers durant le traitement par Spinraza.
Avant que vous ou votre enfant ne receviez Spinraza, votre médecin réalisera un ECG afin de vérifier que vous ou votre enfant ne souffrez pas des troubles du rythme cardiaque. Votre médecin répétera cette analyse à intervalles réguliers durant le traitement par Spinraza.
Il a été rapporté qu’après traitement par Spinraza, les patients développaient une hydrocéphalie (accumulation d’une quantité excessive de liquide autour du cerveau). L’installation d’un dispositif appelé «dérivation ventriculo péritonéale» pour traiter l’hydrocéphalie a été nécessaire chez certains de ces patients. Si vous remarquez des symptômes tels qu’une augmentation du volume de la tête, une diminution du niveau de conscience, des nausées, vomissements ou maux de tête persistants ou d’autres symptômes qui vous inquiètent, informez votre médecin ou celui de votre enfant afin que le traitement nécessaire soit mis en place. Les bénéfices et les risques de la poursuite du traitement par Spinraza chez les patients porteurs d’une dérivation ventriculo péritonéale ne sont pas connus actuellement.
Informez votre médecin si vous-même ou votre enfant
– souffrez d’une autre maladie,
– êtes allergique, ou
– prenez ou utilisez déjà d’autres médicaments en usage interne ou externe (même en automédication!).
Aptitude à la conduite et capacité à utiliser des machines
Rien n’indique à ce jour que l’aptitude à la conduite et la capacité à utiliser des machines soient affectées par Spinraza.
Votre médecin vous dira si votre maladie vous permet de conduire des véhicules et d’utiliser des machines sans danger.
Spinraza peut-il être utilisé pendant la grossesse ou l’allaitement ?
Si vous êtes enceinte, allaitez, pensez être enceinte ou envisagez une grossesse, demandez conseil à votre médecin avant d’utiliser ce médicament. Il est préférable d’éviter d’utiliser Spinraza pendant la grossesse et l’allaitement.
Comment utiliser Spinraza ?
La dose habituelle de Spinraza est de 12 mg.
Spinraza est injecté comme suit à vous-même ou à votre enfant:
– le premier jour de traitement, jour 0
– puis vers le jour 14, le jour 28 et le jour 63
– puis une fois tous les 4 mois.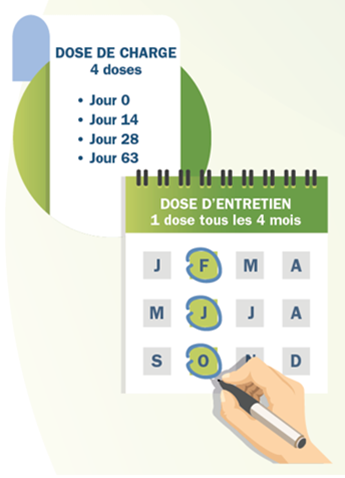
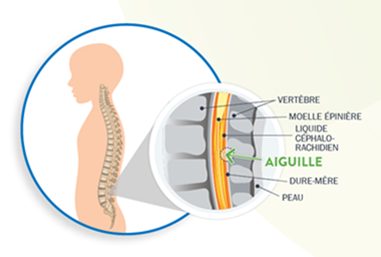
Spinraza est administré chez vous ou chez votre enfant par injection dans le bas du dos. Cette injection, appelée ponction lombaire, est réalisée en insérant une aiguille dans l’espace qui entoure la moelle épinière. Le traitement est administré par un médecin expérimenté dans la réalisation des ponctions lombaires. Vous ou votre enfant recevez éventuellement aussi un médicament qui détend ou endort pendant le traitement.
Pendant combien de temps faut-il utiliser Spinraza ?
Votre médecin vous indiquera pendant combien de temps vous ou votre enfant devez recevoir un traitement par Spinraza. N’arrêtez le traitement par Spinraza que si votre médecin vous dit expressément de le faire.
Les informations disponibles sur une durée d’utilisation supérieure à 3 ans à compter du début du traitement sont limitées pour le présent médicament. Les données disponibles pour les patients âgés de plus de 18 ans sont limitées.
En cas d’omission d’une injection
Si vous ou votre enfant n’avez pas reçu une dose de Spinraza, parlez-en à votre médecin afin de pouvoir administrer dès que possible le traitement par Spinraza.
Si vous avez des questions sur l’utilisation de Spinraza, adressez-vous à votre médecin.
Quels effets secondaires Spinraza peut-il provoquer ?
Comme tous les médicaments, ce médicament peut provoquer des effets secondaires, mais ils ne surviennent pas systématiquement chez tous les patients.
Adressez-vous à votre médecin si vous-même ou votre enfant présentez des effets secondaires qui vous gênent ou qui persistent pendant une période prolongée.
Effets secondaires liés à la ponction lombaire
Des effets secondaires liés à la ponction lombaire peuvent survenir pendant ou peu après l’administration de Spinraza. Dans la majorité des cas, ces effets secondaires surviennent dans les 72 heures suivant l’administration. Les effets secondaires liés à la ponction lombaire peuvent être maux de tête, maux de dos, ou des vomissements.
Les effets secondaires les plus fréquents survenus chez les patients traités par Spinraza ont été:
– fièvre
– rhume
– toux
– constipation
Très fréquent (concerne plus d’une personne sur 10)
– toux
– rhume
– maux de dos
– maux de tête
– vomissements
– pousée dentaires
Fréquent (concerne 1 à 10 personnes sur 100)
– infection urinaire
– rhume des foins
– saignement de nez
– chute
– otite (infection des oreilles)
– diarrhée
– flatulence
– perte de poids
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
– infection grave liée à la ponction lombaire (par exemple méningite)
– hydrocéphalie (accumulation d’une quantité excessive de liquide autour du cerveau)
– méningite aseptique (méningite non causée par une infection)
– réaction d’hypersensibilité (une réaction allergique ou de type allergique pouvant comprendre des gonflements, une éruption cutanée ou des démangeaisons)
– arachnoïdite (inflammation de la membrane entourant la moelle épinière. Elle peut se manifester par des signes tels que des picotements ou des douleurs brûlantes dans le bas du dos ou dans les jambes, ainsi que des fourmillements, un engourdissement ou une faiblesse dans les jambes).
Effet sur la croissance
L’utilisation de Spinraza pourrait provoquer une réduction de la croissance, comme l’ont révélé des mesures de la taille corporelle réalisées dans le cadre d’une étude contrôlée contre placebo. On ne sait pas si l’éventuel effet de Spinraza sur la croissance est réversible lors d’une interruption du traitement.
Si vous ou votre enfant remarquez des effets secondaires, veuillez en informer votre médecin. Ceci s’applique en particulier aux effets secondaires non mentionnés dans cette notice d’emballage.
À quoi faut-il encore faire attention ?
–
Que contient Spinraza ?
Principes actifs
Chaque flacon de 5 ml contient du nusinersen sodique équivalant à 12 mg de nusinersen. Un millilitre contient 2,4 mg de nusinersen.
Excipients
Dihydrogénophosphate de sodium dihydraté (E339), hydrogénophosphate disodique (E339), chlorure de sodium, chlorure de potassium (E508), chlorure de calcium dihydraté (E509), chlorure de magnésium hexahydraté (E511), hydroxyde de sodium (E524), acide chlorhydrique (E507), eau pour préparations injectables.
Numéro d’autorisation
66495 (Swissmedic).
Où obtenez-vous Spinraza ? Quels sont les emballages à disposition sur le marché ?
Seulement dans les centres hospitaliers spécialisés dans les maladies neuromusculaires, sur ordonnance médicale.
Titulaire de l’autorisation
Biogen Switzerland SA, 6340 Baar.
Cette notice d’emballage a été vérifiée pour la dernière fois en décembre 2023 par l’autorité de contrôle des médicaments (Swissmedic).
Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 07.02.2024, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans le paragraphe en gras juste ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 2ème mise à jour de cette page depuis le lancement début 2021 de cette rubrique. Mise à jour 1 (octobre 2021).
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


