Pergoveris® 150 UI/75 UI
Information destinée aux patients en Suisse
Qu’est-ce que Pergoveris et quand doit-il être utilisé ?
Pergoveris contient de l’hormone folliculostimulante, la follitropine alfa (abrégée r-hFSH) et de l’hormone lutéinisante, la lutropine alfa (abrégée r-hLH). Ces hormones, appelées gonadotrophines, sont obtenues en laboratoire par génie génétique.
Pergoveris est administré pour provoquer la croissance et le développement des ovules (follicules) chez les femmes qui n’ovulent pas à cause d’une production très faible des hormones de fertilité (FSH et LH).
Pergoveris ne peut être utilisé que sur prescription du médecin et sous stricte surveillance médicale.
De quoi faut-il tenir compte en dehors du traitement ?
Le médecin choisit le traitement approprié à chaque patiente. Suivez scrupuleusement ses instructions et présentez-vous aux examens de contrôle.
Quand Pergoveris ne doit-il pas être pris/utilisé ?
Pergoveris ne doit pas être utilisé:
– en cas d’ovaires hypertrophiés et de kystes ovariens (cavité remplie de liquide dans le tissu des ovaires) d’origine inconnue (à l’exception de lésions polykystiques bénignes des ovaires),
– en cas de saignements vaginaux d’origine inconnue,
– en cas de cancer des ovaires, de l’utérus et des seins,
– en cas de tumeur du cerveau (dans l’hypothalamus ou l’hypophyse),
– en cas de maladie thyroïdienne ou surrénale non traitée,
– en cas de grossesse ou d’allaitement,
– en cas d’allergie connue à l’hormone folliculostimulante (FSH), à l’hormone lutéinisante (LH) ou à l’un des excipients,
– lorsque votre état ne permet pas d’avoir une grossesse normale, par exemple, en cas de ménopause précoce, de malformations des organes sexuels ou de tumeurs bénignes de l’utérus (comme des myomes).
Quelles sont les précautions à observer lors de la prise/de l’utilisation de Pergoveris ?
Avant de commencer le traitement, les causes exactes de l’infertilité du couple devront être examinées.
Syndrome d’hyperstimulation ovarienne (SHO)
Même si le respect des doses recommandées et des examens de contrôle prescrits réduit le risque d’effets secondaires, l’apparition d’un syndrome d’hyperstimulation ne doit pas être négligée. Ce syndrome est caractérisé par une augmentation excessive du volume des ovaires et des signes comme des douleurs dans la région abdominale basse, pouvant être associés à des nausées, des vomissements, une sensation de maladie, des troubles respiratoires ou une prise de poids rapide (voir Quels effets secondaires Pergoveris peut-il provoquer ?).
Dans de très rares cas, des complications telles qu’une torsion des ovaires et des saignements dans la cavité abdominale peuvent être observées.
En cas d’apparition de tels signes, veuillez contacter sans attendre votre médecin. Dans les cas pour lesquels le développement d’un syndrome d’hyperstimulation ovarienne se dessine, il est conseillé de ne pas administrer de choriogonadotropine humaine (hCG), un autre médicament qui joue également un rôle important dans la fécondation, et d’éviter tout rapport sexuel pendant au moins 4 jours, à moins d’utiliser un contraceptif adapté (méthode barrière).
Le syndrome d’hyperstimulation ovarienne se manifeste généralement entre 1 et 2 semaines après l’injection d’hCG. Sa sévérité peut considérablement varier.
Le risque de syndrome d’hyperstimulation ovarienne est plus élevé chez les femmes qui suivent un traitement visant à stimuler la maturation de plusieurs follicules; ce risque peut cependant être réduit en aspirant tous les follicules avant l’ovulation.
Afin de réduire le risque de SHO ou de grossesses multiples, il est recommandé de pratiquer des examens échographiques et de mesurer le taux sanguin d’estradiol.
Grossesses multiples
Le risque de grossesses multiples après une fécondation in vitro est lié à votre âge et au nombre d’ovocytes/d’embryons transférés. Chez les patientes traitées dans le cadre d’une induction de l’ovulation, la fréquence des grossesses et des naissances multiples est plus élevée qu’en cas de conception naturelle. Toutefois, ce risque peut être réduit en utilisant les doses et le schéma thérapeutique recommandés.
Grossesse ectopique
Les femmes ayant des antécédents de pathologie tubaire ont plus de risques de faire une grossesse ectopique (l’embryon s’implante en dehors de l’utérus).
Fausses couches
Le taux de fausses couches après avoir eu recours à une fécondation in vitro (FIV) ou à une stimulation ovarienne est plus élevé que celui rencontré dans la population générale.
Malformations
Les malformations après une fécondation in vitro (FIV) peuvent être plus fréquentes qu’en cas de conception naturelle. Cela peut être dû à la présence de certains facteurs de risque chez les parents, comme l’âge de la mère, l’hérédité, le recours à une FIV et des grossesses multiples.
Présence de caillots de sang (événements thromboemboliques)
Si vous présentez des facteurs de risque connus (obésité, tabagisme, antécédents personnels ou familiaux positifs pour ce genre d’événements) de formation de caillots dans les grands vaisseaux sanguins (événements thromboemboliques), le risque peut être majoré pendant le traitement par Pergoveris. Il est toutefois à noter qu’une grossesse majore ce risque de la même façon (voir Quels effets secondaires Pergoveris peut-il provoquer ?).
Tumeurs
Des tumeurs des ovaires et d’autres organes reproducteurs, aussi bien bénignes que malignes, ont été rapportées chez des femmes ayant subi des cycles de traitement répétés en vue du traitement de l’infertilité. Des cas isolés de mélanomes malins ont été signalés. Il n’a pas été établi jusqu’à présent si un traitement de l’infertilité augmente ou non le risque d’apparition de ces tumeurs.
Porphyrie
Si vous ou un membre de votre famille présentez une porphyrie (un trouble du métabolisme pouvant être transmis aux enfants par les parents et dû à un problème de synthèse de l’hémoglobine), vous devez en informer votre médecin, car l’utilisation de certains médicaments peut déclencher une poussée de cette maladie.
Si vous remarquez que votre peau se fragilise ou cloque facilement (en particulier les zones fréquemment exposées au soleil) et/ou que vous avez des douleurs au niveau de l’estomac ou des membres, vous devez en informer votre médecin, qui peut alors vous recommander d’arrêter le traitement.
Réactions d’hypersensibilité
Des cas isolés de réactions allergiques non graves ont été rapportés sous Pergoveris. Si vous avez eu des réactions allergiques à ce type de médicaments, informez-en votre médecin.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude n’a été réalisée pour évaluer les effets sur l’aptitude à conduire des véhicules et à utiliser des machines. Une somnolence pouvant néanmoins survenir après l’utilisation de Pergoveris, vous devez faire preuve de prudence si vous conduisez un véhicule ou utilisez des machines.
Autre
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement «sans sodium».
Veuillez informer votre médecin ou votre pharmacien si
– vous souffrez d’une autre maladie
– vous êtes allergique
– vous prenez déjà d’autres médicaments (ou utilisez déjà d’autres médicaments en usage externe) (même en automédication!).
Pergoveris peut-il être pris/utilisé pendant la grossesse ou l’allaitement ?
Pergoveris ne doit pas être administré si vous êtes enceinte ou si vous allaitez.
Comment utiliser Pergoveris ?
Votre médecin adapte le traitement par Pergoveris spécifiquement à chaque patiente et contrôle son efficacité. C’est pourquoi les recommandations posologiques suivantes n’ont qu’une valeur indicative. Veuillez suivre exactement les instructions de votre médecin.
Pergoveris s’injecte sous la peau (par voie sous-cutanée).
La dose habituelle recommandée est de 1 flacon de Pergoveris par jour pendant 3 semaines par voie sous-cutanée. Selon votre réponse, votre médecin pourra augmenter la dose de follitropine alfa de 37.5 UI à 75 UI, à intervalles de 7 à 14 jours. Votre médecin peut décider de prolonger votre traitement jusqu’à 5 semaines.
Quand la réponse désirée a été obtenue, une injection unique d’hCG est faite 24 à 48 heures après la dernière injection de Pergoveris. Il est alors recommandé d’avoir un rapport sexuel le jour même et le jour suivant l’administration d’hCG. Alternativement, une insémination intra-utérine ou une autre procédure d’assistance médicale à la procréation peut être pratiquée selon l’avis du médecin.
Si une réponse excessive est obtenue, le traitement doit être interrompu et l’hCG ne doit pas être administrée (voir Quels effets secondaires Pergoveris peut-il provoquer ?). Votre médecin vous prescrira pour le cycle suivant une dose de follitropine alfa inférieure à celle du cycle précédent.
Utilisation chez les enfants et les adolescents
Pergoveris ne doit pas être utilisé chez les enfants et les adolescents.
Utilisation chez les personnes âgées
Pergoveris ne doit pas être utilisé chez les personnes âgées.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
Informations relatives à l’auto-injection
Si vous injectez vous-même le produit sous la peau, il est important que votre médecin vous montre comment pratiquer l’injection pour garantir l’efficacité optimale de Pergoveris et prévenir les infections. Lisez attentivement les instructions figurant à la fin de cette notice.
Si vous avez utilisé plus de Pergoveris que vous n’auriez dû:
Les effets d’un surdosage avec Pergoveris ne sont pas connus; néanmoins, un syndrome d’hyperstimulation ovarienne n’est pas exclu (voir Quelles sont les précautions à observer lors de l’utilisation de Pergoveris ?).
Si vous avez oublié d’injecter Pergoveris ?
N’injectez pas de double dose pour compenser la dose que vous avez oublié d’injecter. Contactez votre médecin.
Quels effets secondaires Pergoveris peut-il provoquer ?
Les effets indésirables les plus fréquents après l’application de Pergoveris sont: kystes ovariens, syndrome d’hyperstimulation ovarienne d’intensité légère à modérée, maux de tête, somnolence, ballonnements, douleurs abdominales, nausées, vomissements, diarrhée, crampes dans le bas-ventre, douleurs dans les seins, douleurs dans le bas-ventre et réactions locales au site d’injection (douleur, rougeur, démangeaison, hématome, gonflement et/ou irritation).
Après un traitement par Pergoveris, un syndrome d’hyperstimulation ovarienne (SHO) peut survenir, notamment si de la choriogonadotropine humaine (hCG) a été administrée (voir Quelles sont les précautions à observer lors de l’utilisation de Pergoveris ?). Ce syndrome est caractérisé par de volumineux kystes ovariens. Les premiers symptômes d’une hyperstimulation ovarienne sont des douleurs dans le bas-ventre, pouvant être associées à des nausées, des vomissements et une prise de poids. Si ces symptômes surviennent, un examen médical approfondi doit être pratiqué dès que possible.
Occasionnellement, un syndrome d’hyperstimulation ovarienne sévère avec augmentation significative du volume des ovaires et accumulation de liquide dans l’abdomen ou dans le thorax peut survenir. Très rarement, on peut alors observer des complications plus graves telles que la formation de caillots sanguins pouvant obstruer les vaisseaux et ainsi provoquer des douleurs thoraciques, une gêne respiratoire, un accident vasculaire cérébral ou un infarctus du myocarde.
Si les symptômes cités précédemment apparaissent au cours du traitement à base de Pergoveris, vous devez l’interrompre immédiatement et contacter votre médecin afin que celui-ci procède à un examen médical approfondi. Dans une telle situation, votre médecin décidera de suspendre le traitement à base de Pergoveris et l’hCG ne devra pas être administrée.
De très rares cas de réactions allergiques à Pergoveris ont été rapportés, faisant état de rougeur, d’éruptions cutanées, de tuméfaction, d’urticaire et d’une gêne respiratoire. Ces réactions peuvent parfois être graves. Si vous remarquez l’un de ces symptômes, contactez votre médecin sans délai.
Une aggravation de l’asthme peut survenir très rarement chez les patientes asthmatiques.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin, votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d’emballage.
À quoi faut-il encore faire attention ?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Délai d’utilisation après ouverture
La solution préparée ne doit pas être administrée si elle contient des particules ou si elle est trouble.
La solution préparée doit être injectée immédiatement.
Cette solution est à usage unique. Les quantités résiduelles doivent être jetées.
Remarques concernant le stockage
Ne pas conserver au-dessus de 25 °C.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques complémentaires
Rapportez à votre point de vente (médecin ou pharmacien) tout médicament restant à la fin du traitement ou périmé, afin que celui-ci puisse être éliminé de façon appropriée.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d’une information détaillée destinée aux professionnels.
Que contient Pergoveris ?
Pergoveris 150 UI/ 75 UI
Principes actifs
Un flacon de poudre contient comme principes actifs 11 microgrammes de follitropine alfa (r-hFSH), correspondant à 150 UI (Unités Internationales) et 3 microgrammes de lutropine alfa (r-hLH), correspondant à 75 UI (Unités Internationales).
Excipients
Poudre: saccharose, phosphate monosodique monohydraté, phosphate disodique dihydraté, méthionine, polysorbate 20, acide phosphorique concentré et hydroxyde de sodium.
Un flacon de solvant contient 1 ml d’eau pour préparations injectables.
Numéro d’autorisation
58154 (Swissmedic)
Où obtenez-vous Pergoveris ? Quels sont les emballages à disposition sur le marché ?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Emballages contenant 1 ou 10 flacons de Pergoveris en poudre et le nombre correspondant de flacons de solvant.
Titulaire de l’autorisation
Merck (Suisse) SA, Zoug
Cette notice d’emballage a été vérifiée pour la dernière fois en avril 2022 par l’autorité de contrôle des médicaments (Swissmedic).
Instructions concernant la préparation et l’administration de la solution à injecter
Pergoveris est injecté sous la peau (voie sous-cutanée). Il faut dissoudre la poudre avec le solvant et procéder à l’injection immédiatement après la préparation de la solution. Il est conseillé de changer de site d’injection à chaque injection.
Si vous injectez vous-même le produit, lisez attentivement les instructions suivantes:
– Lavez-vous préalablement les mains. Il est important que vos mains soient aussi propres que possible.
– Regroupez tout ce dont vous avez besoin et placez tous les accessoires sur une surface propre: un flacon de Pergoveris en poudre, un flacon de solvant, deux cotons imbibés d’alcool, une seringue, une grosse aiguille pour la reconstitution de la solution et une aiguille fine pour l’injection sous-cutanée, un collecteur de déchets permettant l’élimination sans danger de verre et d’aiguilles.
– Enlevez le capuchon protecteur du flacon de solvant. Montez la grosse aiguille sur la seringue et aspirez de l’air dans la seringue en tirant sur le piston à peu près jusqu’à la graduation 1 ml. Puis, introduisez l’aiguille dans le flacon, poussez sur le piston de façon à expulser l’air, retournez le flacon la tête en bas et aspirez doucement tout le solvant.
– Reposez la seringue sur la surface de travail avec précaution, en veillant bien à ne pas toucher l’aiguille.
– Préparez la solution à injecter: enlevez le capuchon protecteur du flacon de Pergoveris en poudre, prenez votre seringue et injectez lentement le solvant dans le flacon de poudre (1). Remuez très doucement, sans enlever la seringue. Ne pas agiter.
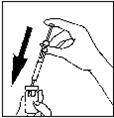
(1)
– Une fois la poudre dissoute, ce qui, en général, se produit immédiatement, vérifiez que la solution obtenue est limpide et ne contient pas de particules. Retournez le flacon la tête en bas et aspirez doucement la solution obtenue dans la seringue (2).
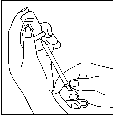
(2)
– Remplacez l’aiguille de reconstitution par l’aiguille plus fine pour injection sous-cutanée et éliminez les éventuelles bulles d’air présentes dans la seringue de la manière suivante: tenez la seringue avec l’aiguille d’injection dirigée vers le haut et tapotez doucement la seringue avec les doigts jusqu’à ce que l’air se rassemble au niveau de la pointe (3). Poussez lentement sur le piston jusqu’à ce que les bulles d’air aient disparu.
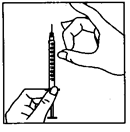
(3)
– Injectez immédiatement la solution: votre médecin ou votre infirmière vous aura déjà indiqué les zones d’injection (par ex.: le ventre, la partie avant des cuisses). Désinfectez la peau au niveau du site d’injection choisi avec un coton imbibé d’alcool.
– Pincez fermement la peau entre deux doigts et enfoncez l’aiguille d’un coup sec (avec un angle de 45 à 90 degrés). Effectuez l’injection sous la peau, comme on vous l’a montré. N’injectez jamais directement dans une veine. Injectez la solution en poussant le piston doucement. Prenez tout le temps nécessaire pour injecter toute la solution.
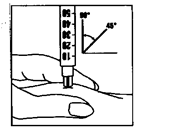
(4)
– Retirez l’aiguille immédiatement après et frottez le site d’injection avec un coton imbibé d’alcool en faisant des mouvements circulaires.
– Jetez tous les accessoires utilisés. Une fois l’injection terminée, jetez immédiatement toutes les aiguilles, seringues et flacons en verre vides dans le collecteur de déchets. Jetez les éventuels résidus de la solution injectable.
Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 27.09.2022, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans un paragraphe en gras ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 1ère mise à jour de cette page depuis le lancement début 2021 de cette rubrique. MAJ 1 (27.09.2022)
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


