Ovamex®
Information destinée aux patients en Suisse
Qu’est-ce que l’Ovamex et quand doit-il être utilisé ?
Ovamex contient du ganirélix qui inhibe l’effet de l’hormone naturelle de libération des gonadotrophines (GnRH). La GnRH régule la sécrétion des gonadotrophines (hormone lutéinisante (LH) et hormone folliculostimulante (FSH)). Les gonadotrophines jouent un rôle important dans la fertilité et la reproduction humaines. Chez la femme, la FSH est responsable de la croissance et du développement des follicules dans les ovaires. Les follicules sont de petites vésicules rondes qui contiennent les ovules. La LH est nécessaire à la libération des ovules matures par les follicules et les ovaires (ovulation). Ovamex inhibe l’effet de la GnRH, ce qui provoque en particulier une inhibition de la sécrétion de LH.
Chez les femmes qui se soumettent à une procréation assistée, y compris la fécondation in vitro (FIV) et d’autres méthodes, une ovulation peut occasionnellement se produire trop tôt, ce qui provoque une diminution considérable de la probabilité de tomber enceinte. Ovamex est utilisé afin d’empêcher une augmentation précoce de la LH et, par conséquent, une ovulation précoce.
Ovamex est une solution injectable stérile, prête à l’emploi, que l’on injecte par voie sous-cutanée (sous la peau).
Ovamex n’est disponible que sur prescription médicale.
De quoi faut-il tenir compte en dehors du traitement ?
Le traitement par Ovamex doit uniquement être prescrit par un médecin expérimenté en médecine de la procréation.
Ce médicament vous a été prescrit pour votre usage personnel, en association avec d’autres médicaments. Il ne faut pas le donner à d’autres personnes car il pourrait leur être néfaste, même si ces personnes présentent les mêmes symptômes que vous.
Portez toujours sur vous un carnet de santé mentionnant les médicaments que vous utilisez. Cela peut être très précieux en cas d’accident.
Au besoin, assurez-vous que d’autres personnes qui vivent avec vous ou s’occupent de vous ont bien lu cette notice.
Quand Ovamex ne doit-il pas être utilisé ?
N’utilisez pas Ovamex dans les cas suivants:
– en cas d’hypersensibilité au ganirélix ou à l’un des autres constituants d’Ovamex
– en cas d’hypersensibilité à la GnRH ou à un analogue de la GnRH;
– pendant la grossesse ou l’allaitement.
Si cela vous concerne, veuillez informer votre médecin avant d’utiliser ce médicament.
Quelles sont les précautions à observer lors de la prise/de l’utilisation de Ovamex ?
– Si vous êtes allergique.
– Si vous souffrez d’une maladie allergique aiguë, veuillez en informer votre médecin. Selon la sévérité du problème, votre médecin décidera si des contrôles supplémentaires seront nécessaires au cours du traitement.
– Dès la première dose, des cas de réactions d’hypersensibilité locales et généralisées ont été rapportés, tels une urticaire, des gonflements au niveau du visage, des lèvres, de la langue et/ou du pharynx pouvant entraîner des difficultés à respirer ou à déglutir (angio-œdème et/ou réactions anaphylactiques). Si vous présentez une réaction allergique, arrêtez le traitement par Ovamex et consultez immédiatement un médecin.
– Si vous présentez actuellement de graves symptômes d’allergie, vous devez en informer votre médecin avant la première injection.
– Si vous constatez, après une injection, une réaction locale étendue ou une réaction généralisée à tout le corps, vous devez en informer votre médecin avant l’injection suivante.
Il existe une légère augmentation du risque de grossesse extra-utérine (grossesse qui se développe dans les trompes de Fallope ou dans la cavité abdominale) chez les femmes suite à l’utilisation de techniques de procréation assistée. Votre médecin effectuera une échographie au début de la grossesse afin de confirmer qu’il s’agit d’une grossesse intra-utérine.
La survenue de malformations congénitales après utilisation d’une technique de procréation assistée pourrait être légèrement plus élevée que lors d’une conception normale. On suppose que cette légère augmentation est à attribuer aux propriétés des patients qui se soumettent à un traitement de l’infertilité (par exemple, âge de la femme, propriétés des spermatozoïdes), ainsi qu’à la survenue plus fréquente de grossesses multiples suite à l’utilisation de techniques de procréation. La fréquence des malformations congénitales suite à l’utilisation d’une technique de procréation assistée avec Ovamex ne se distingue pas de la fréquence observée suite à l’utilisation d’autres analogues de la GnRH dans le cadre d’une technique de procréation assistée.
Chez les femmes pesant moins de 50 kg ou plus de 90 kg, l’innocuité et l’efficacité d’Ovamex n’ont pas été évaluées.
Il n’existe pas suffisamment de données concernant la sécurité d’emploi d’Ovamex chez les patientes présentant une atteinte modérée à grave de la fonction hépatique ou rénale.
On n’a pas étudié les effets d’Ovamex sur l’aptitude à la conduite et la capacité à utiliser des machines. Pour la conduite d’un véhicule ou l’utilisation de machines, il faut toutefois tenir compte du fait que des vertiges ont été rapportés en tant qu’effet indésirable dans le cadre de l’utilisation de ganirélix.
L’éventualité d’interactions avec d’autres médicaments d’usage courant ne peut pas être totalement exclue.
Signalez les médicaments que vous utilisez à tout médecin qui vous soigne.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par seringue préremplie c.-à-d. qu’il est essentiellement «sans sodium».
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d’une autre maladie, vous êtes allergique ou vous prenez déjà d’autres médicaments (même en automédication!) ou utilisez déjà d’autres médicaments en usage externe.
Ovamex peut-il être pris/utilisé pendant la grossesse ou l’allaitement ?
Il ne faut pas utiliser Ovamex pendant la grossesse et l’allaitement.
Comment utiliser Ovamex ?
Posologie
Ovamex est utilisé dans le cadre des techniques de procréation médicalement assistée (PMA), y compris la FIV. La stimulation des ovaires par la FSH peut être entreprise au deuxième ou au troisième jour de vos règles. Il faut injecter Ovamex (0,25 mg) une fois par jour, directement sous la peau. La première injection devrait être administrée le cinquième ou le sixième jour de l’administration de FSH. Votre médecin décidera du moment approprié en fonction de votre réponse à la FSH. Ovamex et la FSH doivent être administrés à peu près au même moment, mais il ne faut pas mélanger les deux produits. Il faut choisir des sites d’injection différents. Il faut injecter Ovamex une fois par jour jusqu’à obtention d’un nombre suffisant de follicules de taille adéquate. La maturation finale des ovules dans les follicules peut être provoquée par l’administration d’hCG.
Le délai écoulé entre deux injections d’Ovamex, de même que le délai entre la dernière injection d’Ovamex et l’injection d’hCG ne doit pas dépasser 30 heures, faute de quoi un pic prématuré de LH risque de survenir. C’est pourquoi, si Ovamex est injecté le matin, il faut poursuivre le traitement par Ovamex pendant toute la durée du traitement par gonadotrophine, y compris le jour du déclenchement de l’ovulation. Si Ovamex est injecté l’après-midi, la dernière injection d’Ovamex doit être effectuée l’après-midi de la veille du jour du déclenchement de l’ovulation.
Ovamex est présenté dans des seringues préremplies et il faut l’injecter lentement, juste sous la peau (par exemple dans la cuisse). Il est possible que vous constatiez une ou plusieurs petites bulles d’air dans la seringue préremplie. Ceci est un phénomène attendu et l’élimination de la/des bulle(s) d’air n’est pas nécessaire. Dans certains cas, la patiente ou son partenaire peuvent réaliser eux-mêmes les injections. Il faut changer de site d’injection lors de chaque injection (de préférence dans la cuisse). Votre médecin vous donnera toutes les instructions à ce propos. Si vous pratiquez vous-même les injections ou si vous les faites pratiquer par votre partenaire, il faut respecter rigoureusement les directives ci-après. Ne mélangez jamais Ovamex à d’autres médicaments.
Préparation du site d’injection
Lavez-vous soigneusement les mains à l’eau et au savon. Tamponnez le site d’injection avec un désinfectant (par exemple chlorhexidine à 0,5%) afin d’éliminer les bactéries de la surface de la peau. Désinfectez une surface d’environ 5 cm autour du site d’injection et laissez le désinfectant sécher pendant au moins une minute avant de poursuivre.
Retirez le capuchon protecteur de l’aiguille. Pincez un gros pli de peau entre le pouce et l’index et introduisez l’aiguille à la base du repli de peau, en formant un angle de 45° avec la surface de la peau. Choisissez un site d’injection différent pour chaque injection (de préférence dans la cuisse). Veuillez observer le mode d’emploi ci-dessous.
Vérification de la bonne position de l’aiguille
Si l’aiguille est correctement introduite, vous avez du mal à tirer sur le piston. Si du sang est alors aspiré dans la seringue, cela signifie que la pointe de l’aiguille a pénétré dans un vaisseau sanguin. Dans ce cas, il faut retirer la seringue et comprimer le site d’injection avec un tampon imprégné de désinfectant. Normalement, l’hémorragie cesse au bout de 1 à 2 minutes. N’utilisez plus cette seringue, jetez-la conformément aux directives. Reprenez toute la procédure avec une nouvelle seringue.
Injection de la solution
Quand l’aiguille est correctement enfoncée, poussez lentement et régulièrement sur le piston de façon à ce que la solution soit correctement injectée et que l’injection ne provoque aucune blessure des tissus cutanés.
Retrait de la seringue
Retirez rapidement la seringue et comprimez le site d’injection avec un tampon imprégné de désinfectant. Les seringues préremplies ne doivent être utilisées qu’une seule fois et il faut les jeter selon les modalités recommandées, une fois l’injection terminée.
Élimination
Jetez la seringue préremplie usagée dans un conteneur à déchets spécial, conformément aux instructions du médecin, du personnel soignant ou du pharmacien. Ne replacez PAS le capuchon de protection sur la seringue préremplie.
Autres informations:
– Si vous avez injecté une dose excessive d’Ovamex, consultez votre médecin.
– Si vous avez oublié d’injecter Ovamex, il ne faut pas injecter une dose double pour compenser l’oubli! Quand vous constatez que vous avez oublié une injection, injectez la dose oubliée dans les meilleurs délais.
Si le retard est de plus de 6 heures (de sorte que le délai entre deux injections dépasse 30 heures), injectez dans les meilleurs délais la dose oubliée et demandez à votre médecin de vous conseiller sur la conduite à tenir.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l’efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Ovamex peut-il provoquer ?
Lors de l’utilisation d’Ovamex, les effets secondaires suivants peuvent survenir:
Ovamex peut provoquer des réactions cutanées au site d’injection (une rougeur avec ou sans gonflement a été signalée chez 10-15% des patientes). En général, ces réactions disparaissent dans les 4 heures suivant l’injection.
Dans des cas fréquents, on peut noter des maux de tête, des nausées et des hémorragies vaginales.
Des vertiges et des douleurs abdominales sont des effets secondaires qui peuvent se manifester occasionnellement.
Dans des cas très rares, chez moins de 1 patiente sur 10 000, des réactions allergiques – y compris les symptômes suivants – susceptibles de se manifester dès l’administration de la première dose ont été observées (voir «Quelles sont les précautions à observer lors de l’utilisation d’Ovamex ?»):
– éruption cutanée;
– visage enflé;
– difficulté à respirer (dyspnée);
– gonflements au niveau du visage, des lèvres, de la langue et/ou du pharynx pouvant entraîner des difficultés à respirer ou à déglutir (angio-œdème et/ou réactions anaphylactiques);
– urticaire.
Dans le cadre de l’hyperstimulation ovarienne contrôlée, on a observé d’autres effets indésirables, mais ceux-ci sont vraisemblablement sans rapport avec l’administration d’Ovamex (par exemple douleurs dans le bas-ventre, ballonnements, syndrome d’hyperstimulation ovarienne (SHSO), grossesse extra-utérine (grossesse se développant dans les trompes de Fallope ou dans la cavité abdominale) et fausse couche (veuillez vous référer à la notice de votre préparation de FSH)).
Si vous présentez des troubles particuliers quelconques dont vous suspectez qu’ils sont en relation avec l’administration d’Ovamex, signalez-les à votre médecin ou à votre pharmacien.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d’emballage.
À quoi faut-il encore faire attention ?
Ne pas conserver au-dessus de 30°C. Conserver hors de portée des enfants.
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Contrôlez la seringue avant l’utilisation. N’utilisez que des seringues provenant d’emballages intacts contenant une solution limpide et exempte de particules.
Rapportez les médicaments entamés ou devenus inutiles à votre pharmacie, qui se chargera de leur destruction.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d’une information détaillée destinée aux professionnels.
Que contient Ovamex ?
Ovamex est une solution aqueuse transparente pour injection. La solution est stérile, prête à l’emploi et destinée à l’injection par voie sous-cutanée. Le capuchon de protection de l’aiguille contient du caoutchouc élastomère (4800 GS) et un arrêt de piston en caoutchouc élastomère, lequel entre en contact avec le produit.
Chaque seringue préremplie de 0,5 ml contient
Principes actifs
0,25 mg de ganirélix sous forme d’acétate de ganirélix.
Excipients
Hydroxyde de sodium, acide acétique, mannitol et eau pour préparations injectables.
Le pH peut avoir été ajusté avec de l’hydroxyde de sodium et de l’acide acétique.
Numéro d’autorisation
68792 (Swissmedic)
Où obtenez-vous Ovamex ? Quels sont les emballages à disposition sur le marché ?
En pharmacie, seulement sur ordonnance médicale non renouvelable.
Boîtes de 1 et 5 seringues préremplies.
Titulaire de l’autorisation
Future Health Pharma GmbH, 8620 Wetzikon, ZH
Cette notice d’emballage a été vérifiée pour la dernière fois en juin 2021 par l’autorité de contrôle des médicaments (Swissmedic).
Mode d’emploi
Introduction de l’aiguille
Sortez une seringue préremplie de l’emballage thermoformé et tenez-la par le cylindre. Ne tenez pas la seringue préremplie par le piston.
1-Tenez la seringue préremplie à la verticale et retirez le protège-aiguille.
2-Formez un gros pli de peau en la pinçant entre le pouce et l’index.
3-L’aiguille doit être introduite à la base (partie inférieure) du pli de peau, en suivant un angle de 45°.
4-Retirez rapidement la seringue et comprimez le site d’injection avec un tampon imprégné de désinfectant.
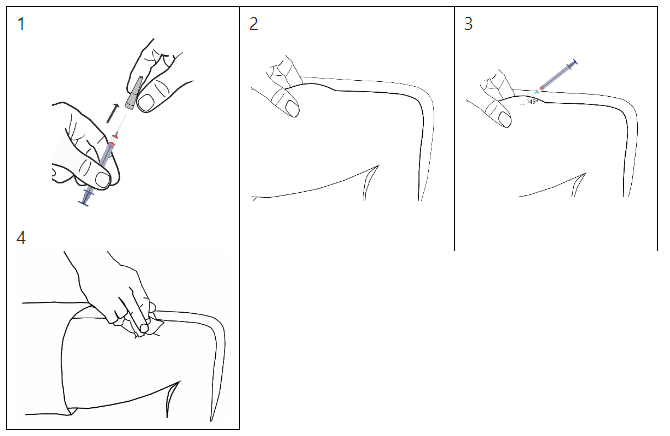
Il convient de changer de site d’injection lors de chaque injection (de préférence dans la cuisse).
Source : Swissmedicinfo.ch
Remarques :
– L’équipe de Creapharma.ch a copié à la main le contenu de Swissmedicinfo le 06.03.2024, attention il ne s’agit pas de la date de mise à jour de la notice du médicament, la date de dernière mise à jour de la notice du médicament est mentionnée dans un paragraphe en gras ci-dessus.
– Comme information interne à Creapharma.ch, il s’agit de la 2ème mise à jour de cette page depuis le lancement début 2021 de cette rubrique. Mise à jour 1 (octobre 2023).
– Swissmedicinfo informe via son site Internet les médicaments mis à jour (via rubrique “Textes modifiés”). Creapharma.ch s’engage dans un délai maximum de 30 jours à mettre à jour chaque page médicament provenant de Swissmedicinfo (rubrique Informations destinées aux patients). Cela signifie que pendant quelques jours cette page ne puisse pas être 100% mise à jour. Pour une information toujours mise à jour (actuelle), consultez directement le site Swissmedicinfo.


