NOVOCART® 3D
ATTENTION SELON SWISSMEDIC (EDITION D’AOUT 2022), CE MEDICAMENT EST HORS COMMERCE (REVOCATION DE L’AUTORISATION) EN SUISSE DEPUIS LE 16.08.2022
Information destinée aux patients en Suisse
Qu’est-ce que le Novocart 3D et quand doit-il être utilisé ?
Novocart 3D est utilisé sur prescription du médecin.
Novocart 3D est un produit transplantable monté sur une matrice comportant des cellules cartilagineuses propres au patient (autologues).
Le produit est utilisé sur une matrice permettant l’implantation de chondrocytes autologues (ICA) sur un cartilage articulaire endommagé localement et sur toutes les couches. Il s’agit d’une intervention chirurgicale visant à reconstruire biologiquement un cartilage articulaire endommagé.
De quoi faut-il tenir compte en dehors du traitement ?
Deux étapes de traitement sont nécessaires pour utiliser Novocart 3D.
Au début, pour fabriquer Novocart 3D, deux cylindres de découpe sont prélevés dans une zone non porteuse du tissu cartilagineux. Cette procédure se déroule dans le cadre d’une arthroscopie. Les cellules issues de ces échantillons de cartilage sont mises en culture et multipliées. Quand un nombre suffisant de cellules est atteint, les cellules sont déposées sur le matériau de support. En général le produit transplantable Novocart 3D ainsi obtenu est prêt à être implanté après environ 3 semaines.
Une deuxième intervention est nécessaire pour introduire le Novocart 3D. Pour de plus amples informations, consultez la documentation patient ou discutez-en avec votre médecin traitant.
Quand Novocart 3D ne doit-il pas être utilisé ou seulement avec précaution ?
La limite d’âge supérieure à considérer pour la réussite d’un traitement par ICA avec Novocart 3D est de 50 ans. Une limite d’âge stricte ne peut toutefois pas être définie car l’âge réel d’une personne ne correspond pas forcément à son âge biologique ni à l’état de l’articulation concernée.
Enfants et adolescents: La sécurité et l’efficacité de Novocart 3D chez les enfants de moins de 18 ans n’ont pas été étudiées. Novocart 3D ne doit donc pas être utilisé chez les enfants et adolescents présentant des cartilages de conjugaison ouverts. La présence de cartilages de conjugaison ouverts est un critère d’exclusion radiologique.
En cas d’hypersensibilité connue ou d’intolérance au principe actif ou à un excipient, par ex. la protéine de bœuf.
Si vous présentez l’un des critères d’exclusion anatomiques et orthopédiques listés ci-après, Novocart 3D ne peut pas être utilisé sur vous:
– usure articulaire ou ostéoarthrose (critère d’exclusion radiologique: modification structurelle supérieure au grade 2 de Kellgren et Lawrence)
– raideur articulaire et arthrofibrose
– déviation de l’axe physiologique de la jambe de plus de 3° (correction peu avant l’ICA)
– résection totale ou partielle du ménisque (une résection partielle inférieure ou égale à un tiers du volume total est autorisée)
– insertion ligamentaire insuffisante (correction peu avant l’ICA)
– mauvaise position ou mauvais glissement de la rotule (correction avant ou pendant l’ICA)
– tige de carbone implantée ou prothèse à charnière
– maladies articulaires inflammatoires (par ex: polyarthrite rhumatoïde)
– lésion du cartilage inférieure à 2,5 cm2 de la surface totale (après préparation de la lésion) pour une utilisation de Novocart 3D en première intention
– lésion du cartilage supérieure à 17 cm2 de la surface totale
– lésions en miroir («kissing lesions»)
– plus de deux dommages cartilagineux indépendants l’un de l’autre sur la même articulation
– enfants et adolescents avec cartilages de conjugaison ouverts
– chondromalasie diffuse (ramollissement des cartilages)
– déformations congénitales ou acquises de la rotule
Les autres critères d’exclusion sont les suivants:
– infections chroniques
– maladies tumorales, présentes ou au cours des 5 dernières années
– arthropathies métaboliques (par ex: goutte/pseudogoutte)
– maladies auto-immunes
– borréliose
– maladies musculaires ou neurologiques aiguës (SLA, SEP)
– adiposité (indice de masse corporelle >30)
– grossesse
– toxicomanie
– maladies psychiques avec réduction de l’observance
– allergie aux protéines de bœuf
– maladies des os (par ex: maladie de Paget), collagénose ou autres maladies lourdes du métabolisme des tissus conjonctifs (par ex: le syndrome Ehlers-Danlos)
– maladie artérielle périphérique
– ostéoporose ou ostéopénie avancée
– hyperparathyroïdie ou hyperthyroïdie primaire
– maladies avec troubles du développement squelettique, comme le syndrome de Stickler, le Spina bifida, l’ostéogenèse imparfaite ou la maladie de Kaschin-Beck
– rachitisme
Quelles sont les précautions à observer lors de l’utilisation de Novocart 3D ?
Des interactions avec d’autres médicaments ne sont pas connues.
L’extrémité opérée ne doit être soumise qu’à des contraintes modérées pendant plusieurs semaines. Une rééducation en plusieurs étapes est prévue. Les sports exerçant une forte contrainte sur l’articulation doivent généralement être évités pendant au moins 1 an.
Veuillez informer votre médecin ou votre pharmacien si
– vous souffrez d’une autre maladie,
– vous êtes allergique ou
– vous prenez d’autres médicaments (même en automédication!)!
Novocart 3D peut-il être utilisé pendant la grossesse ou l’allaitement ?
Aucune expérience clinique sur l’être humain n’est disponible quant à l’utilisation de Novocart 3D pendant la grossesse et l’allaitement.
Si vous vous apercevez que vous êtes enceinte après le prélèvement tissulaire mais avant l’implantation du produit autologue Novocart 3D, les cellules prélevées peuvent être parfaitement conservées par cryoconservation. La transplantation sera alors prévue ultérieurement, une fois la grossesse et l’allaitement terminés.
Si vous vous apercevez que vous êtes enceinte après la transplantation de Novocart 3D, le traitement antidouleur concomitant doit être contrôlé par un médecin et adapté le cas échéant.
Comment utiliser Novocart 3D ?
Le traitement par Novocart 3D nécessite deux interventions chirurgicales. La première intervention consiste en un prélèvement tissulaire. Celui-ci est effectué par le spécialiste à l’aide d’un kit de prélèvement spécial cartilages.
Lors de la deuxième intervention a lieu la transplantation des cellules cartilagineuses autologues cultivées in vitro fixées sur une matrice de support. Pour offrir le meilleur traitement possible à votre lésion cartilagineuse, la lésion est préparée à l’aide d’une curette avant la transplantation, puis le support est coupé ou ajusté en fonction de la taille de la lésion.
Quels effets secondaires Novocart 3D peut-il provoquer ?
Si vous observez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
Les effets indésirables possibles peuvent être répartis en événements survenant à cause de Novocart 3D lui-même ou principalement à cause des interventions chirurgicales liées à Novocart 3D (implantation du produit et prélèvement de cartilages préalablement). D’autres lésions annexes survenant à proximité de la lésion cartilagineuse, comme des lésions des ligaments ou du ménisque de l’articulation du genou, la cause de la lésion et son emplacement peuvent contribuer à déclencher ou aggraver les complications ou les douleurs. En principe, les complications énumérées ci-après peuvent survenir. Si vous ne connaissez pas toutes les termes énumérés dans ce contexte ou que vous avez encore des questions, veuillez vous adresser à votre médecin traitant. Il répondra à toutes vos questions lors d’un entretien explicatif.
Effets indésirables liés à Novocart 3D:
Échec total ou partiel de l’implant ou du traitement, rejet ou nécrose de l’implant, formation locale de cartilages surnuméraires (hypertrophie de l’implant) éventuellement avec formation d’une surface articulaire irrégulière, dissolution totale ou partielle de l’implant et, éventuellement, formation d’un corps articulaire libre bloquant l’articulation, remplissage insuffisant de la lésion, ossification de l’implant ou formation de tissus de remplacement de moins bonne qualité (par ex: fibrocartilage) avec ramollissement du cartilage (chondromalacie) ou dégénérescence du cartilage (chondrose), réactions de type allergique ou autres réactions d’hypersensibilité. Il est également parfois possible, quand le tissu prélevé s’infecte ou que la vitalité ou la qualité des cellules est insuffisante lors de leur culture, que le produit ne puisse être terminé, compromettant ainsi la transplantation. Éventuellement, un nouveau prélèvement de tissus peut s’avérer nécessaire pour fabriquer un autre transplant.
Complications susceptibles de survenir à la suite d’une intervention chirurgicale au genou:
Infections superficielles de la plaie, de l’articulation ou infection systémique, irritation ou inflammation de la membrane synoviale (synovite) ou des ligaments ou tendons de l’articulation, survenue d’un pannus (épaississement de la membrane synoviale) ou d’un plica (œdème avec formation de plis sur la membrane synoviale) avec inflammation articulaire consécutive, fièvre, épanchement articulaire, œdème articulaire, lésion des vaisseaux sanguins avec formation d’un hématome ou épanchement de sang intra-articulaire (hémarthrose), limitation de la mobilité articulaire (arthrofibrose) par multiplication des tissus conjonctifs, formation de cicatrice ou adhérences des parties molles dans l’articulation, lésion du tissu cartilagineux sain, du ménisque ou des ligaments (par ex: ligaments croisés), mauvais positionnement de l’implant, impact sur la mobilité de la rotule, croissance trop importante (hypertrophie) du corps adipeux infra-patellaire dans le genou avec sensation de tension, douleurs et mouvements limités, formation de cicatrices cutanées avec éventuellement douleurs au niveau de la cicatrice, formation de chéloïdes, lésions nerveuses avec troubles de la sensibilité ou manifestations de paralysie, syndrome douloureux régional complexe avec manifestations dystrophiques des extrémités touchées, lésions musculaires, atrophie ou faiblesse musculaire, intolérance au matériau de suture avec apparition de cloques ou troubles de la cicatrisation, thromboses, embolie pulmonaire, choc anaphylactique ou autre événement bénin ou aigu susceptibles d’être liés à l’intervention chirurgicale ou à l’anesthésique employé. Éventuellement des interventions ultérieures sont nécessaires, aussi bien , dues aux effets secondaires indésirables de l’implant que par les complications liées aux interventions chirurgicales nécessaires à l’implantation.
Fréquences des événements indésirables observés après utilisation de Novocart 3D:
Une étude de cas rétrospective portant sur 379 patients, traités par Novocart 3D en raison d’une lésion cartilagineuse localisée, provoquée par un traumatisme, une ostéochondrite disséquante ou une lésion dégénérative localisée au niveau des condyles fémoraux médial et latéral ou de la trochlée, a révélé les *effets secondaires indésirables listés dans le tableau 1 ci-après. *Les fréquences sont données en fonction de la définition suivante: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100); rares (≥1/10’000, <1/1000); très rares (<1/10’000).
Tableau 1:
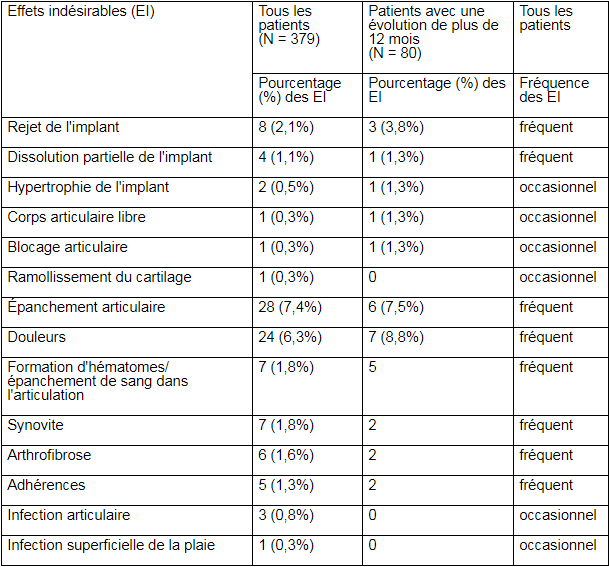
* Les patients peuvent avoir présenté plus d’un événement indésirable.
22 patients sur les 379 (5,8%) ont subi une opération de révision pendant la période de suivi post-opératoire. Les événements en partie constatés seulement au moment de l’opération et possiblement à l’origine de la seconde intervention sont présentés dans le tableau 2 ci-dessous.
Tableau 2:
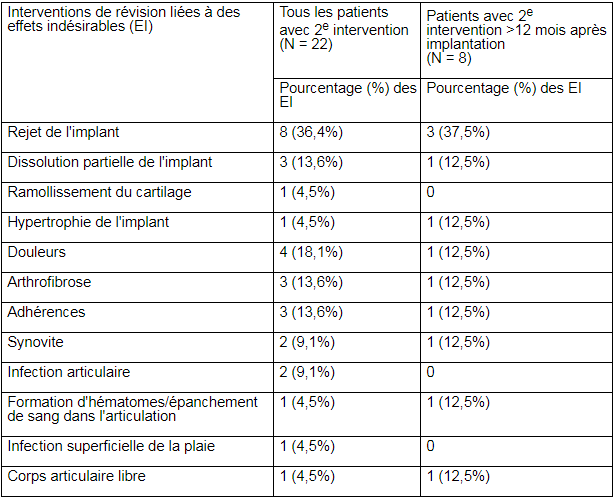
* Les patients peuvent avoir présenté plus d’un événement indésirable.
Dans une étude prospective non interventionnelle menée sur 182 patients (Ø âge des patients: 35,9 ans (15 à 66 ans), Ø taille de la lésion 7,5 cm2 (min: 1 cm2, max: 17 cm2)) et un examen de contrôle jusqu’à 5 ans après l’intervention, un rejet total de l’implant a été observé chez 11 patients et un rejet partiel chez 7 patients. Sur ces 18 patients, 11 avaient été traités en raison d’une lésion dégénérative du cartilage déjà présente.
Tableau 3:

Si vous constatez l’un des effets secondaires listés ci-dessus, veuillez en informer votre médecin.
À quoi faut-il encore faire attention ?
Autres remarques:
Occasionnellement(dans environ 0,3% des cas pour lesquels l’utilisation de Novocart 3D est prévue) l’implant cellulaire ne peut pas être achevé, pour des raisons pharmaceutiques. Si la raison est liée au comportement de prolifération des cellules ou si la qualité du tissu prélevé ou des cellules cultivées est insuffisante, un autre prélèvement peut éventuellement s’avérer nécessaire, pour pouvoir fabriquer votre implant. Une cause peut en être l’infection du tissu prélevé.
Que contient Novocart 3D ?
Produit de transplantation de chondrocytes sur support pour utilisation autologue.
Principe(s) actif(s): Chondrocytes articulaires humains.
Excipient(s)
Matrice collagénique biphasique (collagène d’origine bovine)*, D-glucose, D-pantothénate de calcium, acide folique, L-inositol, nicotinamide, pyridoxine x HCl, riboflavine, thiamine x HCl, acide DL-alpha-lipoïque, biotine, ester méthylique d’acide linoléique, vitamine B12, hypoxanthine, thymidine, putrescine x 2HCl, L-alanine, L-arginine x HCl, L-asparagine x H2O, acide L-aspartique, L-cystéine x HCl x H2O, acide L-glutamique, L-histidine x HCl x H2O, L-isoleucine, L-lysine x HCl, L-méthionine, L-phénylalanine, L-proline, L-sérine, L-thréonine, L-tryptophane, L-tyrosine x H2O x 2Na, L-valine, L-cystéine x 2HCl, glycine, L- glutamine, acide éthanosulfonique 2-[4-(2-Hydroxyethyl)-1-piperazinyl] (HEPES), pyruvate de sodium, NaCl, KCl, MgSO4, NaH2PO4, NaHCO3, FeSO4 x 7 H2O, Fe(NO3)3 x 7 H2O, Na2HPO4, CuSO4 x 5 H2O, ZnSO4 x 7H2O, MgCl2, CaCl2, chlorure de choline, sérum humain, acide L ascorbique, chondroïtine sulfate sodique, albumine humaine, caprylate, N-acetyl-DL-tryptophanate, BMP-2, saccharose, NaOH, polysorbate 80, Huminsulin, métacrésol, glycérol, eau pour injections.
* Le support biocompatible utilisé pour les cellules est un dispositif médical certifié CE.
Numéro d’autorisation
58945 (Swissmedic).
Où obtenez-vous Novocart 3D ? Quels sont les emballages à disposition sur le marché ?
Novocart 3D est utilisé directement par votre spécialiste en milieu hospitalier.
Titulaire de l’autorisation
B. Braun Medical AG, Seesatz 17, 6204 Sempach.
Fabricant
TETEC – Tissue Engineering Technologies AG, Société de conception et de fabrication de substituts tissulaires biologiques, Aspenhaustr. 18, D-72770 Reutlingen (Allemagne).
Cette notice d’emballage a été vérifiée pour la dernière fois en octobre 2014 par l’autorité de contrôle des médicaments (Swissmedic).
Source : Swissmedicinfo.ch (site accédé par Creapharma.ch le 05.04.2021, attention il ne s’agit pas de la date de mise à jour de la notice du médicament. La date de dernière mise à jour de la notice du médicament est mentionnée dans le paragraphe ci-dessus).


